Енергетичні рівні нумерують, починаючи з найближчого до ядра. Встановлено, що максимальне число електронів на енергетичному рівні дорівнює 2n², де n — його номер. Отже, на першому рівні може перебувати не більше 2 електронів, на другому — не більше 8, на третьому — не більше 18, тощо.
Максимальна кількість електронів на кожному рівні обчислюється за формулою: N = 2n2. Число енергетичних рівнів дорівнює номеру періоду, в якому перебуває хімічний елемент. Отже, електронна оболонка атомів елементів першого періоду містить один енергетичний рівень, другого періоду – два, третього – три і т. д.
На другому рівні вже два підрівні: s-підрівень (одна орбіталь) і p-підрівень (три орбіталі).
Електронні енергетичні рівні Головні енергетичні рівні атома — це сукупності атомних орбіталей, що мають однакові значення головного квантового числа. Число таких енергетичних рівнів у атомі дорівнює номеру періоду, в якому розташований відповідний хімічний елемент.
Зовнішня (четверта) електронна оболонка може бути занята максимально 18 електронами (максимальна кількість електронів для електронної конфігурації криптону — [Ar] 3d10 4s2 4p6).
Кількість електронів в кожній оболонці
| рівень/підрівень | 0 (s) | Всього в оболонці |
|---|---|---|
| 3 (M) | 2 | 18 |
| 4 (N) | 2 | 32 |
| 5 (O) | 2 | 50 |
| 6 (P) | 2 | 72 |

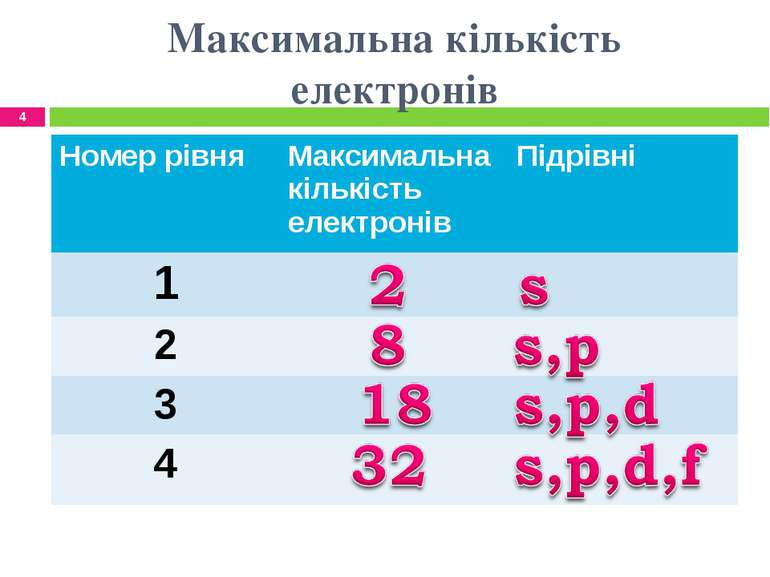
Максимальна кількість електронів, які можуть бути на енергетичному рівні, визначається за формулою: N = 2n2, де n – порядковий номер енергетичного …